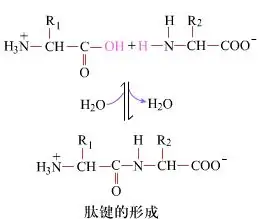
Uz virsmas peptīdu saišu veidošanās, iegūstot dipeptīdus, ir vienkāršs ķīmisks process.Tas nozīmē, ka abas aminoskābju sastāvdaļas ir saistītas ar peptīdu saiti, amīda saiti, vienlaikus dehidrējot.
Peptīdu saites veidošanās ir aminoskābes aktivācija vieglos reakcijas apstākļos.(A) karboksilgrupa, otrā aminoskābe (B) Nukleofīlā aktivētā karboksildaļa pēc tam veido dipeptīdu (AB)."Ja karboksilkomponents (A) nav aizsargāts, peptīdu saites veidošanos nevar kontrolēt."Blakusproduktus, piemēram, lineāros un cikliskos peptīdus, var sajaukt ar mērķa savienojumiem AB.Tāpēc visas funkcionālās grupas, kas nav iesaistītas peptīdu saites veidošanā, peptīdu sintēzes laikā ir jāaizsargā īslaicīgi atgriezeniskā veidā.
Tātad peptīdu sintēze - katras peptīdu saites veidošanās - ietver trīs agregācijas posmus.
Pirmais solis ir sagatavot dažas aminoskābes, kurām nepieciešama aizsardzība, un aminoskābju cviterjonu struktūra vairs nepastāv.
Otrais solis ir divpakāpju reakcija, veidojot peptīdu saites, kurā N-aizsargātās aminoskābes karboksilgrupa vispirms tiek aktivizēta līdz aktīvajam starpproduktam un pēc tam veidojas peptīda saite.Šī saistītā reakcija var notikt vai nu kā viena posma reakcija, vai kā divas secīgas reakcijas.
Trešais solis ir selektīva vai pilnīga aizsargbāzes noņemšana.Lai gan visa noņemšana var notikt tikai pēc visu peptīdu ķēžu salikšanas, ir nepieciešama arī selektīva aizsarggrupu noņemšana, lai turpinātu peptīdu sintēzi.
Tā kā 10 aminoskābes (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec un Cys) satur sānu ķēdes funkcionālās grupas, kurām nepieciešama selektīva aizsardzība, padarot peptīdu sintēzi sarežģītāku.Ir jānošķir pagaidu un daļēji pastāvīgās aizsardzības bāzes, jo ir atšķirīgas prasības attiecībā uz selektivitāti.Pagaidu aizsardzības grupas tiek izmantotas nākamajā darbībā, lai atspoguļotu aminoskābju vai karboksilgrupu funkcionālo grupu pagaidu aizsardzību.Daļēji pastāvīgas aizsarggrupas tiek noņemtas, neiejaucoties jau izveidotajās peptīdu saitēs vai aminoskābju sānu ķēdēs, dažreiz sintēzes laikā.
"Ideālā gadījumā karboksilkomponenta aktivizēšanai un tai sekojošai peptīdu saišu veidošanai (savienošanas reakcijām) jābūt ātrai, bez racēmiskas vai blakusproduktu veidošanās, un, lai sasniegtu augstu ražu, jāizmanto molārie reaģenti."Diemžēl neviena no ķīmiskajām savienošanas metodēm neatbilst šīm prasībām, un tikai dažas ir piemērotas praktiskai sintēzei.
Peptīdu sintēzes laikā dažādās reakcijās iesaistītās funkcionālās grupas parasti ir saistītas ar manuālo centru, vienīgais izņēmums ir glicīns, un pastāv potenciāls rotācijas risks.
Pēdējais posms peptīdu sintēzes ciklā ir visu aizsarggrupu noņemšana.Selektīva aizsarggrupu noņemšana ir svarīga peptīdu ķēdes pagarināšanai papildus prasībai pilnībā noņemt aizsardzību dipeptīdu sintēzē.Sintētiskās stratēģijas ir rūpīgi jāplāno.Atkarībā no stratēģiskās izvēles N var selektīvi noņemt α-amino vai karboksilgrupas.Termins “stratēģija” attiecas uz atsevišķu aminoskābju kondensācijas reakciju secību.Kopumā pastāv atšķirība starp pakāpenisku sintēzi un fragmentu kondensāciju.Peptīdu sintēze (pazīstama arī kā “parastā sintēze”) notiek šķīdumā.Vairumā gadījumu pakāpenisku peptīdu ķēdes pagarināšanu var sintezēt, tikai izmantojot peptīdu ķēdi, lai sintezētu īsākus fragmentus.Lai sintezētu garākus peptīdus, mērķa molekulas ir jāsadala atbilstošos fragmentos un jānosaka, ka tās var samazināt diferenciācijas pakāpi C galā.Pēc atsevišķu fragmentu pakāpeniskas salikšanas mērķa savienojums tiks savienots.Peptīdu sintēzes stratēģija ietver labākā un piemērotākā aizsargfragmenta izvēli, bet peptīdu sintēzes stratēģija ietver piemērotākās aizsargbāzu kombinācijas un labākās fragmentu konjugācijas metodes izvēli.
Izlikšanas laiks: 19. jūlijs 2023