Atbilstoši aminoskābju un cukura savienojuma veidam cukura peptīdu var iedalīt četrās kategorijās: O glikozilēšana, C a N glikozilēšana, rasas saharifikācija un GPI (glikofosfatidliinozitola) savienojums.
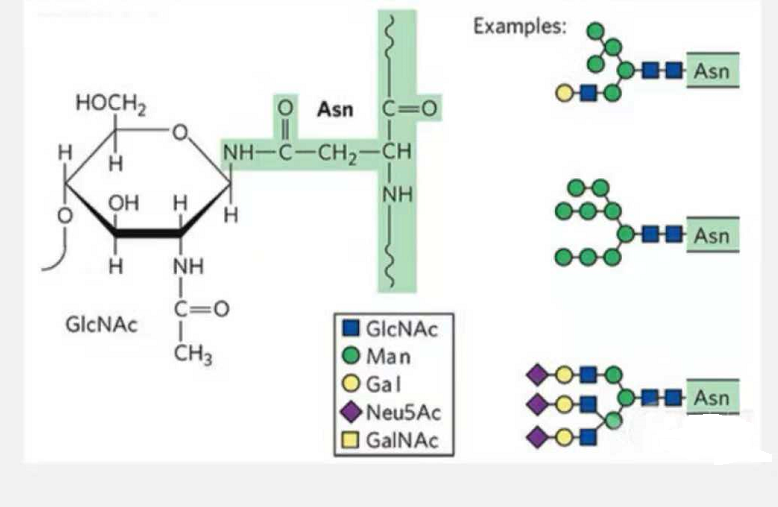
1. N-glikozilācijas glikopeptīdus veido N-acetamīda glikoze glikāna ķēdes reducējošajā galā (Glc-Nac), kas saistīta ar N atomu kāda peptīdu ķēdes Asn sānu ķēdes amīdu grupā, un Asn. kas spēj saistīt glikāna ķēdi, jāatrodas AsN-X-Ser /Thr (X! =P) atlikumu veidotajā motīvā.Cukurs ir N-acetilglikozamīns.
N-glikozilācijas modificēts strukturāls glikopeptīds
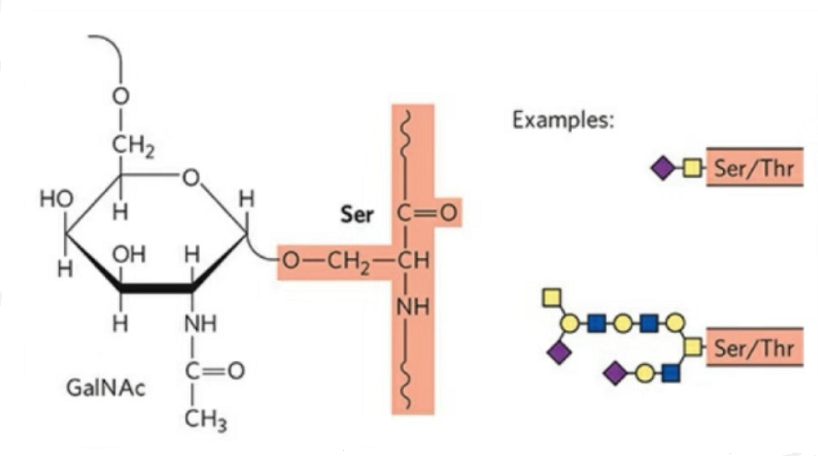
2. O-glikozilācijas struktūra ir vienkāršāka nekā N-glikozilēšana.Šis glikopeptīds parasti ir īsāks par glikānu, bet tam ir vairāk veidu nekā N-glikozilācija.Ser un Thr parasti var būt glikozilēti peptīdu ķēdē.Turklāt ir glikopeptīdi, kas dekorēti ar tirozīna, hidroksilgrupas un hidroksiprolīna glikozilāciju.Saites pozīcija ir hidroksilskābekļa atoms atlikuma sānu ķēdē.Saistītie cukuri ir galaktoze vai N-acetilgalaktozamīns (Gal&GalNAc) vai glikoze/glikozamīns (Glc/GlcNAc), mannoze/mannosamīns (Man/ManNAc) utt.
O-glikozilēšana maina struktūru
3. Glikopeptīda O-GlcNAC glikozilēšana ((N-acetilcisteīns (NAC)) (glcnAcN-acetilglikozamīns/acetilglikozamīns)
Viena N-acetilglikozamīna (GlcNAc) glikozilācija savieno proteīnus O-GlcNAc ar proteīna serīna vai treonīna atlikuma hidroksilskābekļa atomu.O-GlcNA glikozilācija ir O-GlcNAc monosaharīda ornaments bez glikāna pagarinājuma;Tāpat kā peptīdu fosforilēšana, glikopeptīdu O-GlcNAc glikozilēšana ir arī dinamisks olbaltumvielu dekorēšanas process.Nenormāla O-GlcNAc dekorēšana var izraisīt dažādas slimības, piemēram, diabētu, sirds un asinsvadu slimības, audzējus, Alcheimera slimību un tā tālāk.
Glikopeptīdu glikozilācijas punkti
Polipeptīdu un cukura ķēžu pamatstruktūras ir saistītas ar proteīnu ķēdēm ar kovalentām saitēm, un vietas, kas savieno cukura ķēdes, sauc par glikozilācijas vietām.Tā kā nav veidnes, kas sekotu glikopeptīdu cukura ķēžu biosintēzei, dažādas cukura ķēdes tiks pievienotas tai pašai glikozilācijas vietai, izraisot tā saukto mikroskopisko neviendabīgumu.
Glikopeptīdu glikozilācija
1. Glikopeptīdu glikozilācijas ietekme uz terapeitisko proteīnu terapijas efektivitāti
Terapeitisko proteīnu gadījumā glikozilācija ietekmē arī olbaltumvielu zāļu pussabrukšanas periodu un mērķēšanu in vivo
2. Šķīstošā glikopeptīda glikozilācija un proteīni
Pētījumi liecina, ka cukura ķēdes uz olbaltumvielu virsmas var uzlabot olbaltumvielu molekulāro šķīdību
3. Glikopeptīdu glikozilācija un olbaltumvielu imunogenitāte
No vienas puses, cukura ķēdes uz olbaltumvielu virsmas var izraisīt specifiskas imūnās atbildes.No otras puses, cukura ķēdes var pārklāt noteiktas proteīna virsmas virsmas un samazināt tās imunogenitāti
4. Glikopeptīdu glikozilācija, kas palielina olbaltumvielu stabilitāti
Glikozilēšana var palielināt proteīnu stabilitāti pret dažādiem denaturācijas apstākļiem (piemēram, denaturantiem, karstumu utt.) un izvairīties no proteīnu agregācijas.Tajā pašā laikā proteīnu virsmas cukura ķēdes var aptvert arī dažus proteolītiskās sadalīšanās punktus proteīnu molekulās, tādējādi palielinot proteīnu rezistenci pret proteināzēm.
5. Glikopeptīdu glikozilācija, kas ietekmē olbaltumvielu molekulu bioloģisko aktivitāti
Olbaltumvielu glikozilācijas maiņa var arī ļaut olbaltumvielu molekulām veidot jaunas bioloģiskas aktivitātes
Ievietošanas laiks: 03.03.2023